- I. Энзикинетические методы.
- б.) Исследование концентрационной зависимости субстрата
- в.) Изучение субстратной специфичности
- II. ЭЛЕКТРОФОРЕТИЧЕСКИЙ МЕТОД
- Результат электрофореза
Наша команда-партнер Artmisto

Столько, сколько вы выразились.
загрузка
Определение сывороточных уровней активности фермента молочной дегидрогеназы в сочетании с измерением активности других ферментов (например, глутаминовой кислоты, оксалуксусной кислоты, трансаминазы, аланина пируваттрансаминазы, креатинкиназы и т. Д.) Является хорошо известным и широко используемым методом диагностики заболеваний, связанных с разрушением тканей или изменением проницаемости мембран. характеристика. В случае сердечного приступа, ЛДГ составляет ок. Он начинает подниматься через 12 часов и достигает максимальной активности через 48-72 часа. Затем он возвращается в нормальное состояние прибл. В течение 7-12 дней. Скорость увеличения активности ЛДГ пропорциональна степени повреждения миокарда и может достигать трехкратного базового уровня. Тем не менее, повышение уровня LDH в сыворотке может наблюдаться в других случаях (например, анемия, опухоли и заболевания печени), поэтому важно определить, какое повреждение ткани вызвано повышенным уровнем LDH в сыворотке. В этом помогает изучение профиля изофермента ЛДГ. Молекула тетрамера LDH может состоять из двух типов мономеров, которые кодируются отдельным геном, так что их аминокислотный состав различен. Две субъединицы обозначены как H (сердце = тип сердца) и M (мышца = тип мышц), и могут быть созданы пять типов изозимов ЛДГ.
LDH-1 = LDH (H4)
ЛДГ-2 = ЛДГ (Н3М)
LDH-3 = LDH (H2M2)
LDH-4 = LDH (HM3)
ЛДГ-5 = ЛДГ (М4)
В то время как изоферменты ЛДГ-1 и ЛДГ-2 встречаются главным образом в миокарде и эритроцитах, печень и гладкие мышцы содержат изофермент ЛДГ-5. Хотя каждый изофермент катализирует реакцию молочной кислоты + NAD + пировиноградная кислота + NADH + H +, из-за различного аминокислотного состава изоферменты можно различить с помощью ферментативных кинетических методов и гель-электрофореза и последующего окрашивания активности.
I. Энзикинетические методы.
а.) испытание на термостойкость
Образец сыворотки инкубируют в течение 30 минут при комнатной температуре в присутствии NADH + H + при 57 ° C и 65 ° C. Активность фермента молочной кислоты дегидрогеназы определяют из охлажденных образцов. Образец комнатной температуры дает общую активность фермента. Разница в активности LDH образца, инкубированного при 57 ° C и поддерживаемого при комнатной температуре, дает активность LDL (которая представляет собой повышенное заболевание печени). Ферментативная активность, инкубированная при 65 ° С, дает термостойкий ЛДГ, значение которого увеличивается при инфаркте.
б.) Исследование концентрационной зависимости субстрата
Используется физиологически значимое различие, заключающееся в том, что, хотя изофермент ЛДГ-1 максимально активен при концентрации молочной кислоты 250 мМ, фермент ЛДГ1 имеет оптимальную концентрацию молочной кислоты 10 мМ, а молочная кислота 250 мМ является активностью изофермента ЛДГ1. 50% тормозит это. Таким образом, если активность фермента измеряется при концентрации 10 мМ и 250 мМ молочной кислоты, из соотношения измеренных активностей можно определить, содержит ли образец в основном ЛДГ-1 или ЛДГ-5.
в.) Изучение субстратной специфичности
Анализ основан на том факте, что разные изоферменты проявляют разное сродство к 0,33 мМ пирувата или. Использование 3,3 мМ 2-оксобутират (HB) субстратов. Изофермент LDH-1 более активен с оксобутиратом, в то время как изофермент LDH-5 проявляет гораздо более высокую активность фермента при использовании пирувата. Соотношение HBDH / LDH в нормальной сыворотке составляет от 0,63 до 0,81. Если уровень ферментативной активности сыворотки выше 0,81, можно сделать вывод о инфаркте, тогда как значения менее 0,63 указывают на заболевание печени. В этой практике мы будем использовать метод C. обычно используется в клинике. Спектрофотометрическое измерение основано на том факте, что пик поглощения при 340 нм в спектре поглощения молекулы NADH отсутствует в спектре молекулы NAD +. Таким образом, при запуске из оксо-субстрата и NADH в соответствии с уравнением 1 измеряют уменьшение абсорбции на 340 нм в зависимости от времени инкубации, которое пропорционально активности фермента. е 340 нм = 6,22 * 103 см2 / ммоль
решения:
1.) 0,05 М фосфатный буфер, рН 7,5
2.) Растворите 8 × 10-3 М НАДН в фосфатном буфере.
3.) растворяют в 10-2М пирозовой кислоте в фосфатном буфере
4.) растворяют в 10-1М α-кетобутиратфосфатном буфере
5.) фермент ЛДГ-1
6.) Фермент ЛДГ-5
Эксперимент: измерьте следующие компоненты (мл) в кюветах фотометра: 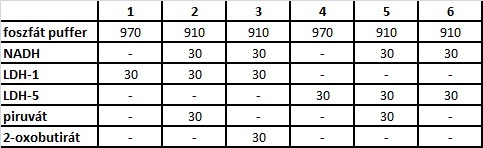
Используя образец 1 в качестве бланка, измерьте начальную активность LDH1 в кюветах 2 и 3, а затем в пирувате или цитокине. Через 15 секунд реакцию инициировали добавлением 2-оксобутирата в кюветы 2 и 3. Поглощение измеряли при 340 нм каждые полминуты. С использованием бланка кюветы 4 фотометрия образцов 5 и 6 выполняется аналогичным образом. Рассчитайте активность фермента из линейного участка кривой времени вымирания. активность фермента (ед / л) = (E * V * 1000) / (мин * 6,22 * v) где:
V - общий объем реакционной смеси [мл]
e NADH 340 нм: 6,22 [см2 × моль-1]
c толщина кюветы [см]
v объем тестируемой сыворотки [мл]
Рассчитайте отношения HBDH / LDH.
II. ЭЛЕКТРОФОРЕТИЧЕСКИЙ МЕТОД
Изоферменты ЛДГ могут быть хорошо разделены с помощью электрофореза. Фермент LDH-1 мигрирует быстрее всего к аноду, и LDH-5 практически не перемещается с места нанесения. Другие изоферменты мигрируют с большей скоростью в анод, в зависимости от молярного соотношения H-субъединицы. Электрофорез может проводиться как на агарозных, так и на целлюлозно-ацетатных и полиакриламидных носителях. Изоферменты можно визуализировать с помощью так называемых. метод окрашивания активности, поскольку ферментативная реакция приводит к образованию нерастворимого цветного продукта в геле, где находится рассматриваемый белок.
материалы
1.) предварительно отлитый 6,5% полиакриламидный гель
2.) Запуск буфера
3.) Образцы ЛДГ в буфере для образцов
4.) 1 М Трис, рН 7,4
5.) 0,01 М НАД +
6.) 1 мг / мл тетразолиевого синего
7) 1,6 мг / мл метазульфата феназина,
8.) 1 М Na-лактат
Выполнение эксперимента: промойте карман для геля для образца приготовленного геля буфером для бегунка, а затем укрепите полиакриламидный гель между стеклянными пластинами в ванне. Пипетируйте 20–40 мл образца из различных препаратов LDH в карманы, затем осторожно положите на образцы рабочий буфер. Заполните полозья, подключите провода (положительный полюс внизу) и добавьте напряжение (до 200 В или 50 мА) к устройству. Через полтора часа, в соответствии с инструкциями практикующего врача, разберите устройство, порвите стеклянные пластины и поместите гель в раствор проявителя (14,8 мл воды, 4 мл 1 М трис-буфера, 12 мл тетразолиевого синего, 4 мл феназина). метасульфат, 4 мл 1 М Na-лактата) и инкубировали при 45 ° С в течение 10 минут в темноте. Вымойте гель водой и высушите его между фильтровальной бумагой. Расположение изоферментов показано на депонированном формазане. В цветовой реакции NAD + является коферментом, лактат является субстратом, феназин метасульфат является носителем электронов, а тетразолиевый синий является конечным акцептором электронов.
Результат электрофореза
Ответьте на следующие вопросы:
1.) Сколько полос вы видите в разных узорах?
2.) Есть ли разница в интенсивности цвета разных полос?
3.) Чем можно объяснить периодическое расположение полос?
4.) Чем объясняются разные миграционные свойства разных изоферментов?
5.) Что является основой для деятельности живописи?
6.) Что лежит в основе спектрофотометрической дифференциальной диагностики?
Сколько полос вы видите в разных узорах?
Есть ли разница в интенсивности цвета разных полос?
Чем можно объяснить периодическое расположение полос?
Чем объясняются разные миграционные свойства разных изоферментов?
Что является основой для деятельности живописи?
Что лежит в основе спектрофотометрической дифференциальной диагностики?



